W prestiżowym czasopiśmie „Nature Plants” (IF 13,3) ukazał się artykuł pt. Photocatalytic LPOR forms helical lattices that shape membranes for chlorophyll synthesis, którego autorami są pracownicy Zakładu Fizjologii i Biochemii Roślin – dr Michał Gabruk i prof. Jerzy Kruk.
W pracy opisany został mechanizm powstawania oraz struktura kompleksów zależnej od światła oksydoreduktazy protochlorofilidu z prekursorami chlorofilu oraz błonami lipidowymi. Uzyskane wyniki mają istotne znaczenie dla ostatecznego zrozumienia przebiegu reakcji syntezy chlorofilu w komórkach roślinnych.
Życie niemal wszystkich organizmów na Ziemi – bezpośrednio lub pośrednio – uzależnione jest od fotosyntezy. To w tym procesie produkowane są związki organiczne, które stanowią nasze pożywienie, oraz tlen, którym oddychamy. Kluczową rolę w procesie fotosyntezy odgrywają cząsteczki chlorofilu. Chlorofil nie tylko nadaje zieloną barwę liściom, ale przede wszystkim pochłania światło słoneczne, którego energia napędza cały proces fotosyntezy.
Biosynteza chlorofilu to skomplikowany szlak, w którym kilkanaście enzymów stopniowo przekształca niewielki, rozpuszczalny w wodzie substrat do związków coraz bardziej hydrofobowych i o coraz lepszych zdolnościach do absorbcji światła. Ostatnia reakcja zachodzi na powierzchni błony lipidowej i prowadzi do powstania chlorofilu. Organizmy fotosyntetyzujące muszą zatem w jakiś sposób kierować prekursory chlorofilu do błony oraz jednocześnie przygotowywać błony lipidowe do umieszczenia w nich gotowych fotosystemów, odpowiedzialnych za fotosyntezę.
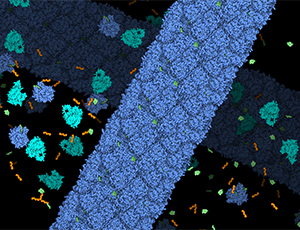
Badania prowadzone od lat 50. ubiegłego wieku wskazywały, że we wszystkie te procesy zaangażowany jest jeden enzym – zależna od światła oksydoreduktaza protochlorofilidu (LPOR). Wiadomo było, że LPOR w ciemności tworzy duże kompleksy wraz z jednym z prekursorów chlorofilu, a po wystawieniu tych kompleksów na światło, enzym przeprowadza reakcję katalityczną, modyfikując związany barwnik do cząsteczki bardzo przypominającej gotowy chlorofil. Jednak mechanizm tworzenia się tych kompleksów, ich struktura ani mechanizm zależnej od światła reakcji nie były znane (rys. 1. Schemat wiązania substratów przez enzym LPOR i jego oddziaływanie z błoną lipidową).
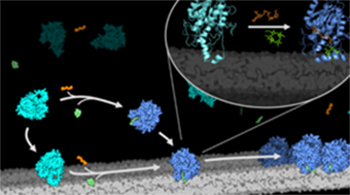
Tematem zajęli się naukowcy z WBBiB. Wykorzystując enzym LPOR, produkowany przez genetycznie zmodyfikowane bakterie a także prekursor chlorofilu, który oczyszczali z siewek pszenicy oraz specjalnie skomponowaną mieszaninę lipidów, soli i innych związków potrzebnych enzymowi do działania, udało im się w krakowskim laboratorium znaleźć warunki, w których LPOR tworzy w probówce kompleksy bardzo podobne do tych znajdowanych w roślinach (rys. 2. Kompleksy LPOR w komórkach roślin).
 Następnie, dzięki technice mikroskopii krioelektronowej i zaangażowaniu badaczy z Uniwersytetu Kalifornijskiego w San Francisco uzyskali tysiące zdjęć tych kompleksów i odtworzyli z nich trójwymiarową strukturę całego układu z niemal atomową rozdzielczością. Badania nad tym problemem trwały ponad pięć lat1, 2.
Następnie, dzięki technice mikroskopii krioelektronowej i zaangażowaniu badaczy z Uniwersytetu Kalifornijskiego w San Francisco uzyskali tysiące zdjęć tych kompleksów i odtworzyli z nich trójwymiarową strukturę całego układu z niemal atomową rozdzielczością. Badania nad tym problemem trwały ponad pięć lat1, 2.
Okazało się, że LPOR, wiążąc swoje substraty, w tym barwnik będący prekursorem chlorofilu, przyłącza się do błony lipidowej, a w niej bezpośrednio oddziałuje z jednym z lipidów. To powoduje zmianę kształtu enzymu, która inicjuje oligomeryzację, tj. łączenie się wielu cząsteczek enzymu w większy kompleks. Oligomeryzacja nie jest jednak przypadkowa: pojedyncze cząsteczki LPOR łączą się tworząc długie nici, które następnie zwijają się razem w grubsze włókno.
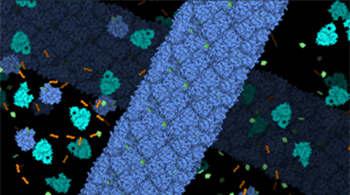
 Dzięki temu, że każda z cząsteczek enzymu wiąże lipidy, błona lipidowa jest wciągana do wnętrza włókna i mocno oplatana przez cząsteczki enzymu, które jednocześnie wciskają w błonę prekursor chlorofilu (rys. 3. Struktura LPOR uzyskana przy pomocy mikroskopii krioelektronowej. Na zielono przedstawiono enzym LPOR, który oplata błonę lipidową oznaczoną kolorem szarym). Cały ten proces jest bardzo szybki i wydajny, przy czym zachodzi tylko w ciemności. Wystarczy błysk światła, a cząsteczki enzymu w obrębie włókna przeprowadzą reakcję katalityczną, co w ciągu kilku minut prowadzi do rozpadu całego kompleksu: uwięzione wewnątrz lipidy są uwalniane wraz z prekursorem chlorofilu wciśniętym w błonę, co stanowi pierwszy etap tworzenia się błon fotosyntetycznych.
Dzięki temu, że każda z cząsteczek enzymu wiąże lipidy, błona lipidowa jest wciągana do wnętrza włókna i mocno oplatana przez cząsteczki enzymu, które jednocześnie wciskają w błonę prekursor chlorofilu (rys. 3. Struktura LPOR uzyskana przy pomocy mikroskopii krioelektronowej. Na zielono przedstawiono enzym LPOR, który oplata błonę lipidową oznaczoną kolorem szarym). Cały ten proces jest bardzo szybki i wydajny, przy czym zachodzi tylko w ciemności. Wystarczy błysk światła, a cząsteczki enzymu w obrębie włókna przeprowadzą reakcję katalityczną, co w ciągu kilku minut prowadzi do rozpadu całego kompleksu: uwięzione wewnątrz lipidy są uwalniane wraz z prekursorem chlorofilu wciśniętym w błonę, co stanowi pierwszy etap tworzenia się błon fotosyntetycznych.
Dzięki uzyskaniu przez naukowców struktury całego aktywnego kompleksu z niemal atomową rozdzielczością wiadomo obecnie w jaki sposób barwnik jest wiązany przez LPOR. To pozwoli w przyszłości poznać mechanizm zależnej od światła reakcji.
Cały proces tworzenia się włókien LPOR i ich akumulowania w dużych ilościach jest szczególnie nasilony w młodych siewkach roślin ukrytych gdzieś przy ziemi, w pąkach drzew czy we wnętrzu kapusty: wszędzie tam gdzie liście nie mają dostępu do światła. Teraz, widząc takie bladożółte tkanki roślin możemy mieć pewność, że rozpadają się w nich powoli włókna LPOR, pomagając tworzyć błony fotosyntetyczne i chlorofil.
1Michał Gabruk: Oligomeryzacja i wiązanie substratów w oksydoreduktazie protochlorofilid. NCN Etiuda 2016/20/T/NZ1/00518.
2Michał Gabruk: Structural properties and function of the oligomers of light-dependent protochlorophyllide oxidoreductase, NAWA PPN/BEK/2018/1/00105.

