Naukowcy z Zakładu Biofizyki Molekularnej odkryli związek między stabilnością wiązania wodorowego w pobliżu hemu b cytochromu bc1 a jego właściwościami oksydoredukcyjnymi i stanem spinowym warunkującym właściwe funkcjonowanie białka.
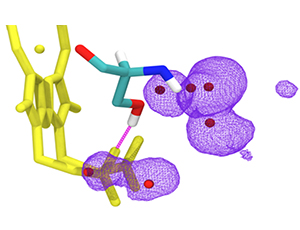
Cytochrom bc1 (mitochodrialny kompleks III) jest enzymem biorącym udział w generowaniu siły protonomotorycznej koniecznej do syntezy ATP – uniwersalnego nośnika energii w komórkach. Mutacje w obrębie tego kompleksu mogą stać się przyczyną chorób mitochondrialnych, choć ich związek przyczynowo-skutkowy nie zawsze jest poznany. Odpowiednik jednej z takich mutacji (powodującej u ludzi nietolerancję na wysiłek) wprowadzony do modelowego organizmu bakterii fotosyntetyzującej Rhodobacter capsulatus ujawnił nietypowe właściwości spektralne hemu oraz zaburzenie reakcji enzymatycznych katalizowanych przez kompleks. Pomiary elektronowego rezonansu paramagnetycznego przeprowadzone w temperaturach ciekłego helu uzupełnione symulacjami dynamiki molekularnej (wykonanymi przy współpracy z naukowcami z Uniwersytetu Helsińskiego w Finlandii) ujawniły, że stabilizacja wiązania wodorowego w rejonie reszt propionowych hemu podnosi potencjał oksydoredukcyjny (Em) hemu destabilizując jednocześnie jego niskospinowy stan w formie utlenionej.
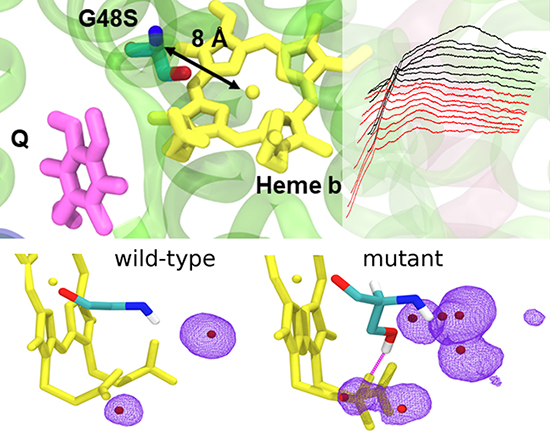
Taka destabilizacja jest efektem niepożądanym w kontekście efektywności przepływu elektronu w całym układzie. Na podstawie tych obserwacji zaproponowano zasadę, w myśl której wpływając na stabilizację wiązania wodorowego przy reszcie propionowej hemu możliwe jest modulowanie wartości Em, przy czym zakres zmian jest ograniczony koniecznością utrzymania właściwego stanu spinowego hemu. Można przypuszczać, że zasada ma charakter uniwersalny odnosząc się do innych białek hemowych a przez to może się też stać pomocna w projektowaniu sztucznych białek/aktywnych redoksowo układów zawierających hemy.
Praca ukazała się w czasopiśmie „Proceedings of the National Academy of Sciences of the United States of America” (PNAS), IF2020 = 11,205. Jej współautorami z UJ są Patryk Kuleta, Marcin Sarewicz, Iwona Ekiert, Robert Ekiert i Artur Osyczka, a z Finlandii: Jonathan Lasham i Vivek Sharma. Projekt był finansowany przez FNP (grant HOMING PLUS dla dra Roberta Ekierta) oraz z funduszy NCN (grant MAESTRO dla prof. Artura Osyczki).
Praca jest dostępna pod adresem: https://www.pnas.org/content/118/33/e2026169118

